Avec l’arrivée du printemps, l’apparition de multiples allergènes tels les pollens, les insectes piqueurs, les acariens, etc. peut déclencher des réactions allergiques chez certains chevaux dont les symptômes se manifestent souvent au niveau cutané et respiratoire.
Quand de tels signes apparaissent, les propriétaires de chevaux font en général appel à leur vétérinaire qui peut alors leur conseiller un test sanguin dans l’espoir de connaître précisément l’allergène mis en cause.
Or, il est très fréquent qu’à l’issue d’un test sanguin demandé suite à l’apparition de troubles respiratoires, le laboratoire ayant réalisé les analyses conclut à une allergie alimentaire. Il s’en suit alors une remise en cause complète de l’alimentation avec le retrait du voire des supposés allergènes.
De même, il arrive qu’à l’issue de ces tests, des chevaux soient déclarés allergiques à tous les allergènes alimentaires testés !
Par conséquent, ce genre de situation peut nous amener à nous questionner sur la fiabilité de ces tests sanguins.
Sachant que chez les humains, environ 50 à 60 % des individus sont dits allergiques, alors qu’en réalité ils ne le sont pas (on parle alors de « faux-positifs ») (source 1), il est légitime de se demander si les tests développés chez les chevaux ne sont pas aussi approximatifs.
Si tel était le cas, quels tests doit-on alors effectuer pour savoir si un cheval souffre réellement d’une allergie alimentaire ?
Définition et mécanismes de la réaction allergique
D’un point de vue général, une réaction allergique correspond à une hypersensibilité d’origine immunologique, provoquant des symptômes reproductibles, objectivables, initiés par l’exposition à un stimulus qui, à la même dose, ne provoque rien chez un individu sain. (Définition de l’International Task Force on Canine Atopic Dermatitis).
Plus spécifiquement, l’allergie alimentaire se caractérise par une réponse immunitaire anormale suite à l’ingestion d’un aliment contenant un ou des antigènes (molécules reconnues par des anticorps ou des cellules du système immunitaire) appelés allergènes. Ces derniers sont responsables de cette réponse immunitaire excessive.
Les symptômes sont reproductibles systématiquement après chaque nouvelle exposition à l’allergène (1).
Les allergènes sont des antigènes capables d’induire une réponse allergique chez des individus génétiquement prédisposés et se trouvant dans un environnement propice (source 4).
Les allergènes peuvent pénétrer dans l’organisme de l’animal par quatre voies :
- Inhalation : via le système respiratoire.
- Ingestion : via la bouche et le système digestif.
- Injection : via la peau, par une piqûre d’insecte ou une aiguille.
- Contact : via la peau (source 2).
Dans le cas d’une allergie alimentaire, la voie d’entrée principale de l’allergène est évidemment l’ingestion (2).
La réaction allergique met en jeu différents mécanismes d’hypersensibilité (classés en quatre types par Gell et Coombs), même si c’est principalement l’hypersensibilité de type I (HSI) qui est déclenchée. Cette hypersensibilité implique une reconnaissance spécifique de l’antigène par le système immunitaire, plus précisément par des anticorps : les immunoglobulines de type E (cf. figure cidessous), d’où le nom également d’allergies IgE-dépendantes.
Les symptômes apparaissant rapidement après contact avec l’allergène, on l’appelle aussi hypersensibilité immédiate (source 5).
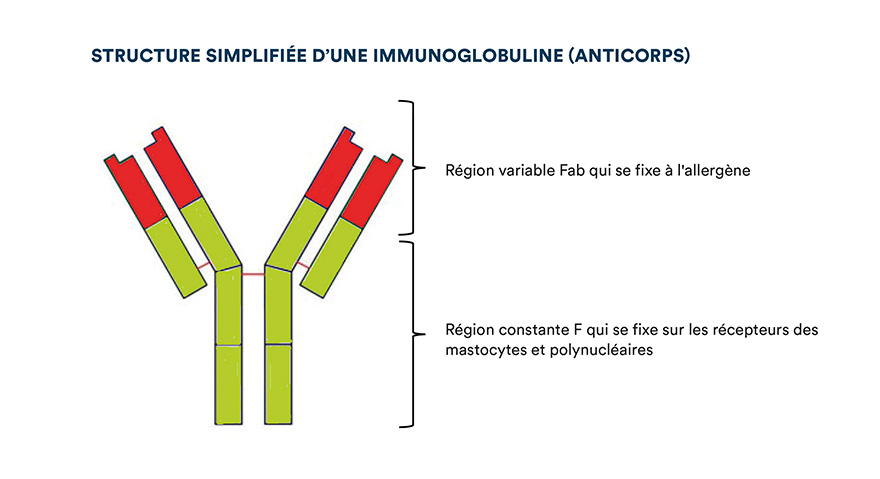
Les immunoglobulines présentent deux fragments (cf. figure au-dessus) : un fragment constant F avec lequel elles se fixent sur les récepteurs des mastocytes et des polynucléaires basophiles, et une région Fab, qui se lie quant à elle à l’allergène. On parle d’IgE spécifique, car cette région Fab est spécifique à un allergène.
Cependant, si deux allergènes ont des conformations très voisines, ces derniers peuvent être reconnus par le même anticorps IgE.
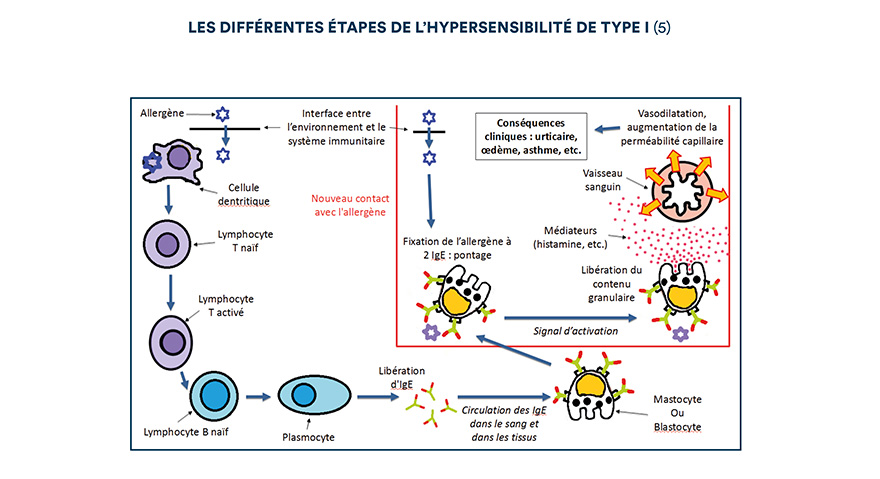
L’hypersensibilité de type I se déroule en deux étapes :
- 1ère étape, dite de sensibilisation, sans signes cliniques : elle peut durer quelques semaines à quelques années. Les cellules présentatrices d’antigènes (appelées cellules dendritiques), présentes dans les tissus frontières entre le milieu extérieur et intérieur (peau, muqueuses respiratoires ou digestives), capturent en permanence les antigènes qui y pénètrent. Une fois les antigènes internalisés, les cellules dendritiques migrent vers les ganglions lymphatiques en finissant leur maturation. Elles interagissent alors avec les lymphocytes T et également avec les lymphocytes B via les lymphocytes T-helper. Les lymphocytes B se transforment en plasmocytes et vont produire une quantité importante d’IgE.
Ces immunoglobulines vont ensuite circuler dans le sang et les tissus, libres ou fixées à la surface des mastocytes et des polynucléaires basophiles. Les IgE peuvent persister plusieurs mois à la surface des cellules mais seulement quelques jours à l’état libre dans le sang (5).
L’hypersensibilité de type I étant une réaction immunitaire normale de défense vis-à-vis des éléments étrangers, tout le monde synthétisent des IgE. Cependant, les individus allergiques se différencient des individus sains sur le plan immunologique car ils en produisent de façon exagérée.
- 2ème étape, la phase lésionnelle ou effectrice : en cas de nouveau contact avec l’allergène, la reconnaissance de ce dernier par les IgE situées à la surface des mastocytes ou, dans une moindre mesure des basophiles, conduit à l’activation en cascade de ces cellules.
Cependant, cette activation nécessite que l’allergène soit au moins divalent, c’est à dire qu’il soit capable de se fixer à deux IgE voisines en même temps. On appelle ce phénomène le « pontage » ou, l’agrégation des IgE par l’allergène. Il entraîne une modification de la structure et de la fonction de la membrane cellulaire, conduisant à un signal d’activation à l’origine d’un épisode de dégranulation, c’est-à-dire à l’excrétion de granulations sécrétoires (contenues dans les mastocytes et les basophiles) dans le milieu extracellulaire.
Ces vésicules limitées par une membrane cytoplasmique renferment les nombreux médiateurs préformés lors de la phase immédiate, notamment des protéases et de l’histamine (médiateur chimique, c’est-à-dire molécule capable d’activer des cellules possédant le récepteur spécifique à l’histamine).
L’histamine se diffuse à travers les tissus et se lie à ses récepteurs : elle engendre alors une vasodilatation et une augmentation de la perméabilité capillaire, conduisant à l’apparition de signes cliniques visibles (urticaire, etc.). Quant aux protéases, elles initient l’inflammation et la dégradation tissulaire locale.
Les symptômes apparaissent généralement en 10 à 20 minutes (5).
Prévalence et signes cliniques des allergies alimentaires vraies
Bien que la prévalence des allergies alimentaires ne soit pas exactement connue chez les chevaux, elle est estimée comme faible (sources 2, 3, 4).
Quant aux signes cliniques, les chevaux peuvent réagir différemment face à un même allergène.
Certains peuvent déclarer des symptômes au niveau des voies respiratoires supérieures (écoulement nasal, éternuement, larmoiement (yeux qui coulent) ou encore head-shaking) quand d’autres vont souffrir de troubles cutanés :
- Prurit (démangeaisons) entraînant souvent une alopécie (chute du poil laissant apparaître la peau), voire des plaies quand le prurit est important et chronique.
- Urticaire (apparition soudaine de nombreuses plaques oedémateuses en relief plus ou moins étendues appelées « plaques ortiées »).
De plus, chez certains chevaux, les symptômes allergiques peuvent apparaître au niveau digestif : baisse d’appétit, diarrhée et même coliques.
Étant donné que de nombreux agents pathogènes peuvent être responsables de ces symptômes, il convient, avant de se prononcer, de procéder à un diagnostic différentiel rigoureux.
Enfin, pour compliquer encore un peu plus les choses, les chevaux peuvent assez souvent être allergiques à plus d’un allergène (2) !
Fiabilité des tests sanguins du commerce
Les tests sérologiques ELISA (Enzyme Linked Immunosorbent Assay) réalisés à partir d’un prélèvement sanguin, sont présentés par les laboratoires qui les commercialisent, comme une alternative reconnue aux tests intradermiques dans le diagnostic des allergies.
Ces tests onéreux classent les composés allergiques en 2 groupes : les aéroallergènes (inhalés dans les voies respiratoires) et les trophallergènes (ingérés par la voie digestive).
Le principe de ces tests immuno-enzymatiques reposent sur le dosage des immunoglobulines E (IgE) spécifiques d’allergènes présentes dans le sérum (fraction du sang) de l’animal.
En pratique, ces tests sont très facilement réalisables.
Le vétérinaire prélève quelques ml de sang au cheval ayant déclaré des signes cliniques compatibles avec une réaction allergique. Ensuite, de retour à sa clinique, il centrifuge le prélèvement et en extrait le sérum qu’il injecte dans un nouveau tube. Ce dernier n’a plus qu’à être envoyé au laboratoire d’analyses.
Aussi, au vu de la facilité de réalisation de ces analyses, il est tentant d’y avoir recours dès qu’on suspecte une allergie.
Cependant il a été démontré chez l’homme, et chez d’autres espèces animales, que dans le cas des allergies alimentaires, ces tests n’étaient pas fiables (sources 6, 7). Chez les Équidés, une étude (1) très récente publiée en 2014 arrive aux mêmes conclusions.
ÉTUDE (1) : “A COMMERCIALLY AVAILABLE IMMUNOGLOBULIN E-BASED TEST FOR FOOD ALLERGY GIVES INCONSISTENT RESULTS IN HEALTHY PONIES”
Un test de détection des allergies alimentaires basé sur le dosage des immunoglobulines E et disponible dans le commerce délivre des résultats incohérents sur des poneys en bonne santé
MATÉRIEL ET MÉTHODES
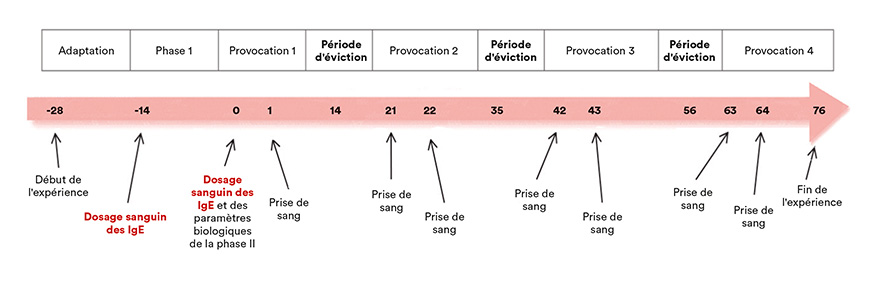
L’étude a été réalisée sur 17 poneys Shetland. Après une période d’adaptation de 14 jours au régime alimentaire, 2 phases expérimentales ont été conduites :
- Phase I : deux tests sanguins visant à doser des IgE spécifiques d’allergènes alimentaires (soja, maïs, mélasse, blé, betterave sucrière, avoine, luzerne, seigle, caroube et orge) ont été effectués, l’un le premier jour et l’autre 14 jours plus tard, soit la veille du début de la phase II.
- Phase II : les poneys considérés, au vu des résultats du test sanguin n°1 de la phase I, comme « positifs » à un ou plusieurs allergènes alimentaires ont débuté les tests de provocation le jour 1 de la phase II.
Chaque poney positif a reçu 100 g de l’allergène présumé deux fois par jour pendant 2 semaines, en plus de la ration de base.
Les poneys « positifs » à plus d’un allergène ont subi plusieurs tests de provocation (un par allergène), séparés par une semaine de repos (sans aucune stimulation), durant laquelle les chevaux n’ont consommé que la ration de base (foin + complément minéral et vitaminique).
Durant cette phase II, le suivi des animaux a été effectué de deux manières :
- Examen clinique : avant et 30 minutes après le premier repas de la phase II, puis toutes les heures pendant 12h, ensuite toutes les 3h pendant les 36h suivantes et enfin, 3 fois par jour pendant 10 jours.
Les paramètres évalués étaient les suivants : fréquences cardiaque et respiratoire, température, présence ou non d’urticaire, de signes de démangeaisons (lésions cutanées, etc.), de coliques ou de diarrhée. - Examens complémentaires (de laboratoire) : le premier jour de la phase II, avant le repas, 6h et 12h après, dosage de l’urée, des lactates et de l’hématocrite. Le lendemain, 1h après le repas, analyse d’une protéine de la phase aiguë de l’inflammation, la SAA (sérum amyloïde A).
RÉSULTATS
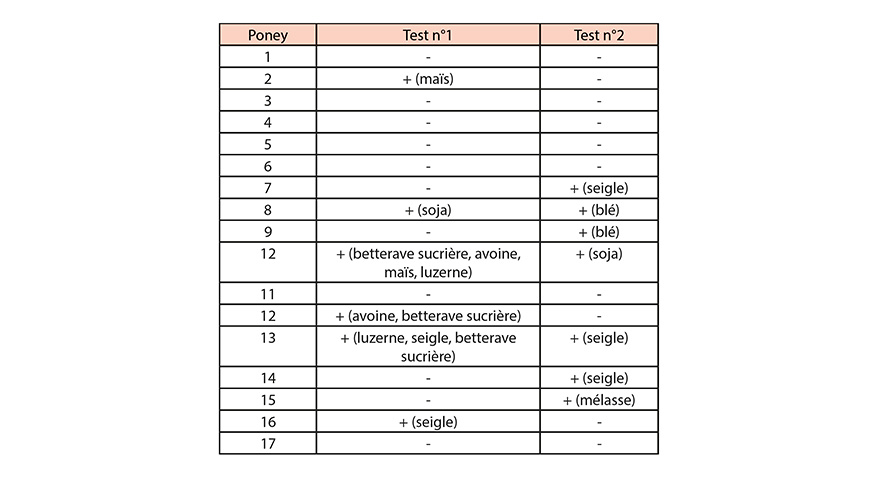
Les résultats des deux tests sanguins réalisés durant la phase I sont présentés dans le tableau ci-dessous :
Test sanguin n°1 : 6 poneys sur 17 (35%) ont été testés positifs dont 3 individus à plusieurs allergènes.
Test sanguin n°2 : 7 poneys sur 17 (41%) ont été testés positifs sachant que pour chaque individu, un seul allergène a été mis en cause.
Au total, 10 poneys sur 17 (59%) ont réagi positivement à au moins un des allergènes alimentaires testés. Sur ces 10 individus « positifs », seuls 3 l’ont été durant les 2 tests sachant qu’un seul poney (n°13) a réagi 2 fois au même allergène (le seigle). Enfin, seuls 7 poneys sur 17 (41%) n’ont réagi à aucun des 2 tests.
Concernant les 6 poneys « positifs » lors du premier test sanguin, les observations relevées lors de la phase II sont les suivantes :
- Paramètres cliniques : aucun signe d’allergie n’a été observé ; seuls 2 poneys ont montré des crottins d’une consistance légèrement anormale (3,5/5 au lieu de 4/5 pour les autres poneys).
- Paramètres sanguins : seul le poney n°13 a vu son taux de sérum amyloïde A (SAA)* augmenter (93,2 mg / l) lors du test de provocation réalisé avec le seigle.
*La SAA est une protéine de la phase aiguë de l’inflammation, produite majoritairement par le foie. Elle est utilisée comme marqueur de l’allergie chez les humains souffrant d’asthme. Cependant, la pertinence de ce marqueur n’a pas encore été testée chez les chevaux.
DISCUSSION
Les résultats de l’étude démontrent que le test de détection des allergies alimentaires disponible dans le commerce et basé sur le dosage des IgE, n’a pas permis d’obtenir des résultats cohérents chez des poneys sains. En effet, plusieurs incohérences ont été observées concernant les résultats des 2 tests sanguins :
- 41 % (7/17) des poneys ont été testés « positifs » à un ou plusieurs allergènes lors du test n°1 mais n’ont pas réagi lors du test n°2 ou inversement,
- Concernant les 3 poneys ayant réagi aux deux tests sanguins, les allergènes suspectés étaient différents d’un test à l’autre. Seul les résultats du poney n°13 sont cohérents pour 1 des 3 allergènes détectés lors du test n°1 que l’on retrouve également dans le test n°2 (seigle).
De plus, aucun des 6 poneys déclarés « positifs » à l’issue du test sanguin n°1 n’a déclaré de signes cliniques en faveur d’une éventuelle allergie lors des tests de provocation de la phase II.
Concernant le poney n°13, même s’il n’a montré aucun signe clinique d’allergie alimentaire, il a été testé à deux reprises positif au seigle. De plus, lors du test de provocation de la phase II impliquant le seigle, l’analyse sanguine réalisée 1h après le repas du 2ème jour a montré une élévation modérée de la protéine de la phase aiguë de l’inflammation SAA. Cette augmentation, jugée comme modérée par les auteurs, est néanmoins révélatrice de la présence d’un stimulus inflammatoire.
Cependant, même si les résultats des tests effectués sur ce poney semblent plutôt cohérents (à l’exception du manque de spécificité du test sanguin n°1 de la phase I), les auteurs de l’étude ne s’avancent pas quant à l’existence d’une possible hypersensibilité du poney n°13 vis-à-vis du seigle.
Concernant la méthode d’analyse, les auteurs de l’étude ont été incapables d’obtenir plus de détails sur le mécanisme exact du test utilisé. Ils ne connaissent donc ni le seuil d’IgE à partir duquel le poney était considéré comme positif, ni le type d’anticorps utilisés dans la détection des IgE contenues dans le sang de l’animal.
Par conséquent, ils ne sont pas en mesure de s’avancer sur la raison exacte de ces résultats incohérents.
Néanmoins, les résultats de cette étude confirme une fois de plus que les tests sanguins disponibles sur le marché ne sont pas validés scientifiquement et qu’ils ne peuvent donc être considérés comme une méthode de diagnostic fiable des allergies alimentaires.
De telles incohérences dans les résultats ont également été observées avec d’autres tests de détection des IgE : intradermiques ou ELISA utilisés dans le but de dépister des allergies cutanées chez des chevaux, mais également avec des tests de dépistage des allergies alimentaires chez les chats, chiens et humains.
CONCLUSION
Les auteurs concluent que le test sanguin de détection des allergies alimentaires basé sur le dosage des IgE, a fourni des résultats incohérents sur des poneys en bonne santé. Ces résultats erronés obtenus à partir de ce test disponible dans le commerce pourraient conduire à des changements inappropriés et non nécessaires de la ration alimentaire visant à supprimer le soi-disant allergène détecté.
Les conclusions de cette étude confirment celles de Wagner (2009) à savoir qu’il n’existe aucune publication scientifique qui valide l’utilisation des tests sanguins pour déterminer les allergies alimentaires (source 8).
Ainsi, bien que ces tests soient très faciles à réaliser, ils ne sont pas fiables. Le taux de faux positifs qu’ils génèrent est important : nombreux sont les individus qui présentent un taux élevé d’IgE sans présenter de signes cliniques d’allergie alimentaire.
La présence importante de faux-positifs pourrait s’expliquer de différentes manières :
- Aucun lien entre le taux d’anticorps dans le sang et celui dans les organes cibles n’a été démontré jusqu’à aujourd’hui (source 9).
- Le taux d’IgE augmente de façon significative en fonction des saisons chez les chevaux sains (source 10).
- Les individus présentant des taux d’IgE élevés ne présentent pas obligatoirement de signes cliniques d’allergie, et par conséquent ne sont pas forcément allergiques (source 11).
- La qualité des allergènes employés : aucune standardisation des allergènes n’a été effectuée pour le moment dans l’espèce équine (9).
- Une même IgE peut se lier à des antigènes différents si ces derniers présentent une structure semblable ou très voisine. On parle alors de réaction croisée. Il est donc impossible en l’état actuel des techniques de dire, lorsque le taux d’IgE est élevé, si ces immunoglobulines se lient à l’allergène « prévu » ou à une molécule similaire à ce dernier (11).
Par conséquent, ces tests sanguins permettent uniquement de détecter une production d’IgE, mais en aucun cas de diagnostiquer une allergie alimentaire.
Quel test effectuer pour savoir si un cheval est allergique ?
INTRADERMORÉACTIONS (IDR)
Les tests cutanés par intradermoréactions permettent de reproduire localement la réaction d’hypersensibilité de type I.
Le ou les allergènes suspectés ainsi qu'un témoin négatif (souvent une solution de glycérine) et positif (codéine et/ou histamine) sont injectés par voie intradermique. Le témoin négatif permet d’écarter une allergie de frottement alors que le second, censé provoquer une réaction locale, assure que l’animal n’est plus sous l’effet de médications antiallergiques qu’il prenait peut-être avant l’examen (6).
Si les mastocytes cutanés sont sensibilisés à un ou plusieurs des allergènes injectés, ils dégranulent et des symptômes locaux (érythème, papule) apparaissent en 10 à 20 minutes (6).
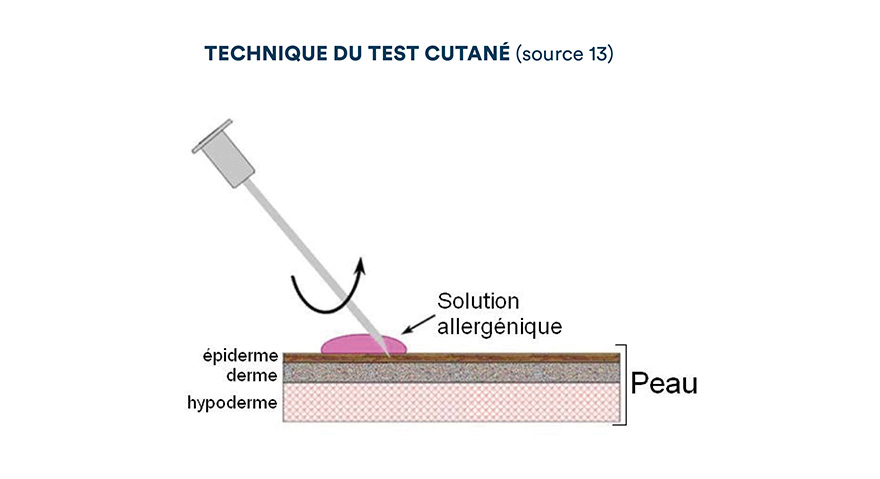
La lecture du test se fait donc par comparaison aux témoins positif et négatif, 15 à 30 minutes après les différentes injections, pour détecter une éventuelle hypersensibilité immédiate puis, à 24 heures pour l’hypersensibilité retardée.
Pour que les tests soient interprétables, le témoin négatif doit correspondre à une papule érythémateuse de moins de 5 mm de diamètre, alors que celle du témoin positif doit présenter un diamètre supérieur à 1 cm. Généralement, un test est considéré comme positif s’il existe un érythème et si le diamètre de la réaction est supérieur ou égal à la moyenne des deux témoins (6).
Même si les test cutanés par intradermoréactions sont plus fiables que les tests sanguins, le risque d’obtenir des faux-positifs et des faux-négatifs reste néanmoins élevé. Ils ne permettent donc pas d’établir un diagnostic d’allergie alimentaire avec certitude.

TEST D'ÉVICTION / RÉINTRODUCTION
Ce test est le plus simple et le plus fiable qui soit car il apporte un lien direct entre l’allergène et les signes cliniques. Il est considéré comme le test de référence chez les hommes, les chats et les chiens (1).
Lorsque l’on suspecte une allergie alimentaire chez un cheval présentant des signes cliniques compatibles avec cette dernière, le test d’éviction consiste à retirer un ingrédient de la ration à la fois jusqu’à ce qu’on observe la disparition des symptômes. En effet, si l’animal guérit en dehors de tout traitement (de quelques jours à 2-3 semaines), il est logique de penser que le dernier ingrédient retiré contient possiblement l’allergène responsable des signes cliniques.
Aussi, après la phase d’éviction vient la phase de réintroduction : le dernier ingrédient retiré (contenant probablement l’allergène) est réintégré dans la ration. Une réapparition rapide des symptômes après cette réintroduction fournit alors la preuve que le cheval est bien allergique à cet ingrédient (6).
NB : d’autres tests sont disponibles chez les chevaux, tels les tests de dégranulation des basophiles, ou de transformation lymphoblastique. Néanmoins, leur fiabilité n’a pas été démontrée (6).
Traitement
En cas d’allergie alimentaire vraie, la première étape du traitement consiste à éliminer l’allergène de la ration.
Une fois que l’allergène a été trouvé puis éliminé, et que les signes cliniques d’allergie ont disparu, le vétérinaire peut alors proposer une immunothérapie spécifique d’allergène, aussi appelée désensibilisation ou vaccination anti-allergène. Le but de cette thérapie est d’habituer progressivement l’organisme à l’allergène en question afin qu’il développe une accoutumance envers ce dernier. Une préparation injectable (« vaccin ») réalisée à partir de l’allergène sélectionné est injectée à des doses croissantes et à intervalles réguliers sous la peau de l’animal, l’objectif étant de développer une tolérance vis-à-vis de l’allergène.
Il est à noter que la désensibilisation est principalement utilisée chez les chevaux souffrant de problèmes de peau ou respiratoires (source 15).
L’ajout d’oméga 3 dans la ration (en utilisant les aliments REVERDY ou via le REVERDY OMEGA OIL) permettrait d’influencer la réponse immunitaire, et par conséquent de diminuer les signes cliniques d’allergie (source 16).
En effet, ils agiraient notamment sur les leucotriènes et les cytokines, médiateurs présents dans les granulations sécrétoires des mastocytes et des basophiles libérés en cas de contact de ces cellules avec l’allergène et à l’origine de certains signes cliniques d’allergie.
Conclusion
Plusieurs études scientifiques ont prouvé que les tests sanguins de détection des allergies alimentaires basés sur le dosage des IgE produisent des résultats incohérents. Ainsi, leur manque de fiabilité peut conduire à des changements inappropriés et non nécessaires de la ration alimentaire.
Par conséquent, quand une allergie alimentaire est suspectée, il est préférable d’avoir recours aux tests d’éviction / réintroduction qui sont moins coûteux et plus fiables.
Bibliographie
(1) Dupont, S., A. De Spiegeleer, D.J. Liu, L. Lefère, D.A. Van Doorn et M. Hesta, A commercially available immunoglobulin E-based test for food allergy gives inconsistent results in healthy ponies, Equine Veterinary Journal, 2014, DOI 10,1111/ evj.12369
(2) Burke D.J., Food allergy in horses – nothing to sneeze at !!, Tribute Equine Nutrition/Kalmbach Feeds, Inc.
(3) Kentucky Equine Research staff, Food allergy testing in horses, EQUINEWS, 3 Novembre 2014.
(4) Waldridge B., Food allergy in horses, Kentucky Equine Research
(5) Hoarau C., Abuaf N., Bérard F., Bienvenu J., Chollet-Martin S., Nicolas J.F, Vitte J., Physiopathologie de l’hypersensibilité immédiate (HSI), association des collèges des enseignants d’immunologies
(6) Bertholdy Thomas, Etude de l’atopie chez les équidés: étude comparative de son traitement chez l’homme et chez le cheval, thèse, janvier 2005.
(7) Pearls and pitfalls of allergy diagnostic testing. Ann Allergy Asthma Immunology, Cox
(8) Wagner B., IgE in horses: occurrence in health and disease, Veterinary Immunology and Immunopathology, Volume 132, Issue 1, 2009, Pages 21–30
(9) Guilford W.G., Jones B.R., Markwell P.J., Arthur D.G., Collett M.G., Harte J.G., Food sensitivity in cats with chronic idiopathic gastrointestinal problems, Journal of Veterinary Internal Medicine, 2001, 15, 7-13
(10) Wilkolel PM, Pomorski ZJ, Szczepanik MP, Adamek L, Pluta M, Taszkum I, Golynski M, Rozwod A, Sitkowski W, Assessment of serum levels of allergen-specific immunoglobulin E in different seasons and breeds in healthy horses, Journal of Veterinary Science, 2014, 17(2):331-7.
(11) Haute Autorité de Santé (HAS), Indications du dosage des IgE spécifiques dans le diagnostic et le suivi des maladies allergiques, Mai 2005
(12) Moneret-Vautrin DA, Kanny G, Halpern G, Detection of antifood IgE by in vitro tests and diagnosis of food allergy.
(13) Le Prick Test, En ligne : http://tpe-pricktest. e-monsite. com/pages/deroulement-duprick-test.html
(14) Animogen, Santé : les allergies chez les chevaux (causes, symptômes, traitements, limites), En ligne : http://www.animogen.com/2015/02/10/sante-les-allergies-chezleschevaux- causes-symptomes-traitementslimites/
(15) Laboklin Labor Klinische Diagnostik, L’immunothérapie spécifique (désensibilisation) chez le cheval, En ligne : http:// www.laboklin.com/pdf/fr/rat_tat/Immuntherapie-pferd-FR. pdf
(16) Grimm H, Mayer K, Mayser P, Eigenbrodt E, Regulatory potential of n-3 fatty acids in immunological and inflammatory processes, British Journal of Nutrition, 87, Suppl. 1, S59-S67, 2002